概述
儿童期肺部肿瘤是一种罕见的恶性肿瘤,占所有原发性肺部恶性肿瘤的0.5% 至1% 。包括肺母细胞瘤(pulmonary blastoma)、胎儿腺癌(fetal adenocarcinoma)和胸膜肺母细胞瘤(pleuropulmonary blastoma ,PPB)3种类型。在2015年世界卫生组织分类中,胎儿腺癌属于腺癌类,肺母细胞瘤属于肉瘤样癌类,胸膜肺母细胞瘤属于间质类。胸膜肺母细胞瘤pleuropulmonary blastoma,PPB)以胚胎间质为特征,发病率极低,在美国每年约发现25-50例。1988 年 Manivel 等观察到此类肿瘤不仅可发生于肺,也可发生于纵隔及胸膜,因此建议将此类肿瘤单独分类,并称其为 PPB。在既往文献中有许多PPB的同义词,包括:
· Cystic mesenchymal hamartoma 囊性间叶性错构瘤
· Mesenchymal cystic hamartoma 间叶性囊性错构瘤
· Pediatric pulmonary blastoma 小儿肺母细胞瘤
· Pneumoblastoma 肺母细胞瘤
· Pulmonary rhabdomyosarcoma 肺横纹肌肉瘤
· Rhabdomyosarcoma in lung cyst 肺囊肿内横纹肌肉瘤
病因
目前国内外研究认为,PPB是DICER1相关疾病。近三分之二的PPB患者有生殖细胞 DICER1基因突变。大约三分之一的胸膜肺母细胞瘤患儿的家族成员表现出一些发育不良和/或肿瘤性疾病,包括 DICER1综合征。大多数基因突变携带者不受影响。DICER1基因突变的外显率与每种病理状态的关系尚不清楚,但肺囊肿、胸膜肺母细胞瘤和甲状腺结节报道最多。大多数相关疾病发生在10岁以下的儿童,卵巢肿瘤和结节性甲状腺肿在儿童和30岁以下的的成人中都有报道。
DICER1基因位于染色体14q32.13,是核糖核酸酶Ⅲ(RNaseIII)基因家族的成员,其基因产物(DICER1蛋白)是microRNAs(MiRNAs)加工过程中的重要组成部分。MicroRNAs是双链非编码RNA的短片段,它在信使RNA(mRNA)水平调节基因表达。mRNA转录后, miRNA以双链“发夹”的形式进入细胞质,被DICER1识别并被切割成两条单链(成熟的miRNA)。这种成熟的、被切割的miRNA能够结合特定的mRNA靶序列,并诱导mRNA降解或抑制转录。而mRNA抑制不足被认为是肿瘤发生的潜在驱动因素。在大约70%-80%的PPB儿童中发现了DICER1的胚系功能缺失突变。这种胚系突变的存在定义了DICER1胸膜肺母细胞瘤家族性肿瘤易感综合征(FTPS)。
临床分型
根据PPB的进展过程,可以分为Ir型、I型、II型和III型。
I型胸膜肺母细胞瘤(纯囊性,图1A)表现为多房充气囊肿,间隔较薄。囊肿内壁附有良性呼吸道上皮细胞和间充质细胞,其下层成分为恶性间充质细胞,可能具有横纹肌母细胞分化能力。大约1/3的PPB在这一初始阶段(I型)被发现,发现时的中位年龄为8个月,其中62%发现于1岁前,97%发现于3岁前。I型PPB的特点:单侧、单灶性、周围型,大小超过5厘米,男性稍多见(57%)。此外,I型PPB可能进展为II型PPB(囊性和实性)。
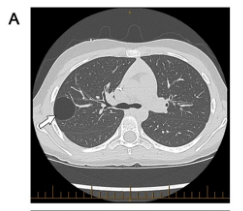
图1A I型胸膜肺母细胞瘤的CT表现
II型(囊实性,图1B)PPB约占1/3,男女比例相等,出现时间晚于I型,中位年龄为35个月(95%在6.8岁前确诊),在12个月前非常少见。III型PPB(实性,图1C)出现年龄较高,中位诊断年龄为41个月,在12个月之前几乎不会出现。III型PPB完全由肿瘤细胞组成,没有囊腔。II型PPB的实质区与III型在组织学上相似,表现为混合的肉瘤成分。这些肉瘤细胞可能包括散布的间变性病灶、胚胎性横纹肌肉瘤、软骨肉瘤或坏死。少数情况下,III型PPB肿瘤坏死可能产生假性囊肿,但这并不能使肿瘤“降级”到II型。
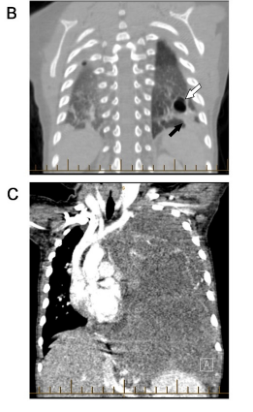
图1B II型胸膜肺母细胞瘤的CT表现;图1C III型胸膜肺母细胞瘤的CT表现;
23%的I型PPB可以“退化”为Ir型PPB。Ir型具有与I型相同的多房囊性表现,但组织学上没有散在的原始恶性细胞。但目前医学上并不能确定Ir型PPB是否含有恶性成分,这些成分日后是否会卷土重来。I型PPB的中位诊断年龄为46.5个月。在II型或III型PPB确诊病例中没有看到类似的“退化”现象。
临床表现
PPB常无特异性临床表现,常仅表现为发热、咳嗽、胸痛等非特异性症状,少数患儿甚至无症状,临床上容易误诊,以误诊为肺炎最为常见。相对而言,I型PPB由于巨大充气囊肿压迫呼吸道,或并发气胸而易出现呼吸窘迫。II 型和 III 型以呼吸困难和胸痛为较多见。同时合并其他全身症状,如咳嗽,发烧,疲劳,食欲下降等。此外,Ⅱ、Ⅲ型 PPB 病灶常可累及纵隔,导致大血管和心脏出现移位;累及邻近肺组织及胸膜导致胸腔积液。大多数患儿于 6 岁以内发病,平均发病年龄 3.2岁,约25%患儿有家族倾向。
诊断与鉴别诊断
结合上述临床表现及辅助检查可作出临床诊断。胸部 CT 检查是最常用的诊断方法。磁共振主要用于脑部和骨骼扫描明确有无远处转移。胸部 CT 检查对于Ⅱ型和Ⅲ型 PPB 具有鉴别诊断的作用,但对于Ⅰ型 PPB 与 CPAM 鉴别较为困难。确诊主要依靠病理学诊断(表1)。此外,PPB需与其他原发于胸壁或肺内其它恶性肿瘤鉴别:如恶性畸胎瘤、胚胎性横纹肌肉瘤、纤维肉瘤、尤文氏瘤和滑膜肉瘤等。

治疗
外科手术是I型和Ir型的首选治疗方案(图2)。是否需要辅助化疗目前尚无统一定论,如果化疗,建议方案为VAC。据报道,术后5年无病生存率(DFS)和总生存率(OS)分别为82% 和91%。大约10% 的病例可能在手术后发展为 II 型或 III 型,辅助化疗似乎不会影响进展和生存率。
Ⅱ型和Ⅲ型应用国际胸膜肺母细胞瘤推荐方案(图2),Ⅱ和Ⅲ型术后需要化疗,化疗方案以IVADo为主,必要时需要2次或3次手术探查。II 型的5年 DFS 和 OS 比率分别为59% 和71%,III 型的5年 DFS 和 OS 比率分别为37% 和53% 。
目前没有针对性的临床研究或大宗的病例报告支持PPB放射治疗的有效性。但如果化疗和手术切除后仍然有无法切除的残余原发瘤灶,建议遵循肺实质辐射的参考剂量,可局部放疗。如出现PPB脑转移,建议手术后放疗。
总言之,早期诊断,早期手术,规范化疗是PPB的总治疗原则。
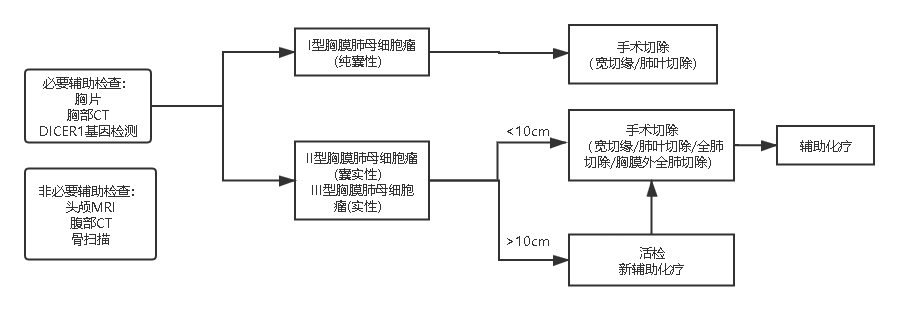
图2胸膜肺母细胞瘤诊疗流程图
预后
Ⅰ型PPB的总生存率为80%-90%,Ⅱ型和Ⅲ型总生存率小于50%。目前文献报道的预后相关因素包括:PPB

